今天我想和大家分享一下关于铁和铜的相对原子质量是多少。以下是小编,对这个问题的总结。让我们来看看。铁和铜的相对原子质量是多少 铁的相对原子质量是56,铜的相对原子质量是64。原子是指化学反应中不可再分的基本粒
2023-12-31 00:24:01

2018年3月启动的国务院机构改革是适应新时期社会主义市场经济体制的行政体制重塑,是提高治理能力的高质量转型。在新体制下,药品监管如果沿用以往的监管思路和方法,监管资源和监管力量可能面临严重问题。如何建立与新监管体系相适应的监管理念,如何在回归企业本质的过程中实现科学监管?摘要:从实施“药品质量受权人制度”的角度,提出监管工作的“牛鼻子”是以制度激励药品生产企业落实主体责任,并介绍了陕西省药品监管的探索实践。
对以往监管理念的反思
近年来,药品监管部门严格按照习近平总书记“四个最严”的指示,完善监管制度,严把源头,严把过程,严控风险,严惩违法违规者,取得了突出成效。但在一些地方,监管越来越严,问责越来越严,而药品生产企业违法违规问题依然严峻。一方面,监管部门总觉得人数不够,责任不压实。既把监管部门的实名贴在墙上,又增加检查频率,总是不靠谱;另一方面,监管干部因怕出事而紧张,筋疲力尽,挤满战术,用时间、频率、痕迹换取安心,甚至因怕被问责而觉得自己是“高危人群”,想逃离。确保药品安全是一个艰巨而长期的过程,不可能一蹴而就。然而,尽管监管力度加大,检查频率增加,责任追究更加严格,但仍存在违法违规、问题产品、安全事故等问题同比不减,效果不佳。
笔者认为,矛盾的根源在于监管理念的偏差:一方面,对企业的管控和惩罚重于引导和疏堵,削弱了对企业责任感的激发,监管部门和企业成了对立和博弈关系。虽然国家多年来非常重视强化企业的主体责任,各级监管部门也在努力推动。但在实际工作中,监管部门强调的是管理和严防,监管部门很难设身处地,站在企业的角度思考如何引导和疏导。这种监管导致企业自律弱化,责任意识淡薄。他们总想应付监管、逃避监管,不学习、不懂法律,重眼前轻长远,甚至重利轻义、藐视法律法规、突破底线、铤而走险。另一方面,监管责任和企业责任错位。企业是药品安全的关键因素,应承担主要责任。但过多强化监管责任,过多追究监管责任,导致“全包式”管理、“保姆式”管理,导致监管责任在一定程度上替代企业主体责任,成为无限责任,甚至出现药品安全问题监管部门为企业“背锅”的现象。
监管理念的偏差必然增加监管难度,结果效率低下,也会伤害监管队伍,影响医药行业发展。
对企业自律的再认识
与他律的辩证关系
自律和他律是内因和外因的关系,是本质和条件的关系。内因是事物变化的决定性因素,外因必须通过内因起作用。经济学家张认为,企业家是市场的主体。资源配置和技术进步都来源于企业家精神的发挥和运用,经济发展要以企业家为中心。笔者认为,这是对企业(企业家)与市场关系的本质概括。
企业最关心的是自身发展,自律是企业的本质要求,主体意识和责任是企业做大做强的内生动力。监管部门的他律是代表政府和社会履行对药品质量安全的监管职责,通过监管激发企业的自律意识和主体责任,强化企业的内在需求和内生动力。首先是生产安全,其次是监督检测。企业是药品质量安全的根本保证,必须自觉承担产品质量安全的一切法律责任;自律不是完全自发的,需要通过其他法律来鼓励合法,惩罚非法,督促企业自觉履行主体责任。新体制下,监管部门要更新监管理念,正确把握药品生产企业自律与他律监管的辩证关系,把激发企业落实主体责任作为监管工作的“牛鼻子”,把企业自觉履行主体责任与监管部门监督企业履行职责有机结合起来,运用多种监管手段和方法,下大力气强化企业自律,最大限度调动企业质量安全积极性。变“保姆式”监管为“裁判式”监管,变“企业安全”为“企业安全”,形成监管部门与企业共同保障安全的新型关系,建立他律监管与企业自律的协同监管体系。
“质量律师制度”是
刺激药品生产企业
落实主体责任的制度安排
关于“药品生产企业质量受权人制度”
对...的深刻理解
在GMP(药品生产质量管理规范)中引入“质量受权人制度”,是我国积极采纳国际先进监管理念的体现。企业法人授权药品质量经理对药品生产质量进行监督管理,对遵守药品生产规范和质量安全保证进行内部审核,承担药品放行责任。
首先,是企业内部权力制衡的制度安排。通过企业法人将药品质量安全充分授权给质量授权人,将产权与质量监管权分离,使质量监管权独立履行药品生产全过程质量安全审核和一票否决,使企业内部审核树立权威,得到保障。这是企业自我管理中决策权、生产权、质监权相互制衡的一种制度设计。其次,是监管部门他律与企业自律对接的制度安排。根据原《中国食品药品监督管理局关于推进药品生产企业实行药品质量受权人制度的通知》(国美国食品药品监督管理局〔2009〕121号),质量受权人必须具备一定的资质,企业在确定质量受权人时应向所在地省级药品监督部门申报,如因故变更药品质量受权人,应及时向药品监督部门说明。各省局应将企业提交的质量授权人况报告纳入企业监管档案,作为日常监管的依据。这从制度上明确了监管部门对药品生产企业的质量和数量受让人负有管理责任。医药企业是生产最重要民生产品的特殊行业。如果企业在市场试错中逐渐形成自律意识,将会付出巨大的代价。因此,在日常监管中,需要建立倒逼机制,激发和强化企业的自律意识,倒逼企业继续落实主体责任。监管部门介入对质量受权人履行职责的监管是这一制度设计的重点。三是制约企业法人(负责人)违法行为的制度安排。企业法人(负责人)是企业的决策者,对其认识的偏差直接干扰了质量授权人的绩效。在《关于推进药品生产企业实行药品质量受权人制度的总体通知》中,授权监管部门管理企业质量受权人,使质量受权人的任免由企业和监管部门共同决定。这就要求质量授权人不仅要对企业负责,还要对监管部门负责,最终要对药品质量安全负责,这将有效制约法人(负责人)的违法行为。
《药品生产企业质量授权人制度》
的实施
根据笔者对各省市的了解,质量律师制度已经建立并运行,起到了一定的作用,但效果并不好。
原因是责任和权限不匹配。被授权人大多是企业质量部门的负责人,对企业的重大质量决策没有知情权和发言权,对企业生产中影响质量安全的行为缺乏制止权;第二,质量律师这个岗位不是相对独立的。有的质量授权人身兼数职,纠结于其他工作,无法充分履行职责,甚至形同虚设;第三,企业法人(负责人)极大地干扰了质量受权人的履行。当企业经济利益与质量安全发生冲突时,法人(负责人)直接干预质量授权人履行职责;第四,监管部门对质量受权人监管不足。当企业出现药品质量安全问题时,监管部门只对企业承担整改责任或许可证收缴处罚,对质量授权人员失职没有处罚,警示和问责力度不够。
这些问题使得制度没有发挥应有的作用,甚至质量授权人掩盖了企业的违法行为,使企业的自律和主体责任缺位。从根本上说,这是对制度的认识和细化不足,执行过程中的随意性和随意性导致制度没有发挥应有的作用。
陕西省监理实践
陕西省药品监管部门在全面实施机构改革的过程中,深刻认识到新体制下监管方式的重塑和转型,需要监管理念的重塑和转型。监管部门要探索风险监管与智慧监管相结合的科学监管之路,监管责任与企业主体责任相结合的协同共治之路,质量安全与产业振兴的共赢之路。在对生产企业的监管中,要围绕这一根本思想调整监管模式,牢牢把握以监督他人促进企业自律这条主线,给企业真正的动力,促进企业创业。
《陕西省药品生产企业》的修订
《质量授权人员管理办法》
2018年4月至9月,针对原《陕西省药品生产企业质量受权人管理法》存在的不足,陕西省药品监管部门深入企业调研,多次召开座谈会,与各级监管干部和企业各级人员进行座谈,对《办法》进行了大幅修改。
第一,提高质量授权人的资格,“应由同级副总经理担任”。二是细化强化权限,由GMP中的三项职责增加到七项职责:参与企业质量管理体系建立、内部自检、验证、不良反应报告、产品召回等质量管理活动;建立健全药品生产质量控制体系,负责监控质量管理体系,确保其有效运行;建立药品品种档案,确保严格按档案信息生产,严格按规定变更程序;履行药品生产的所有法律法规和技术规范,确保生产过程持续符合规定,所有数据真实、完整、可追溯;行使每批产品的批准决定权。强化四项否决权:主要材料供应商的选择;主要生产设备和仪表的选择;生产、质量、材料、设备和工程部门关键人员的选择;对产品质量有关键影响的活动。第三,对企业法人的责任提出了明确的要求。企业法人应当充分授权质量受资助者,支持质量受资助者的工作,确保受资助者在履行职责时不受内部因素的干扰,充分发挥其在药品质量管理体系中的作用。第四,明确了药监部门的问责处罚。一方面,如果质量受权人在履行职责时受到企业内部因素的干扰,企业法人不支持质量受权人的工作,法人的行为将被通报批评。另一方面,质量代理人不认真履行职责被责令再次改正上述行为的,或者不认真履行职责的,建议企业调整质量代理人,同时由陕西美国食品药品监督管理局(原陕西美国食品药品监督管理局)向社会公示。
此次修订明确了以下关系:一是质量受权人的责、权、利关系。委托给质量受权人的责、权、利必须对等,有权利才能履行职责,奖惩分明。二是监管部门与质量受权人的关系。监督部有权对质量受权人进行管理,并明确管理的方式和方法。三是法人与代理人的关系。明确了被授权人对法人安全管理决策权的限制,从制度上确立了被授权人的独立性和权威性,消除了法人对被授权人工作的干扰。
药品生产企业授权人
做出了新的任命。
2018年9月,原陕西美国食品药品监督管理局出台《陕西省药品生产企业质量受权人管理法》(以下简称《管理法》),要求各药品生产企业按照新规变更企业质量受权人,并于2018年底前报陕西省药品监督管理局备案。陕西美国食品药品监督管理局对各企业拟变更的质量授权人进行了严格审查,不符合要求的企业重新选择。全省217家药品生产企业全部更换了质量负责人,并按时上岗。
敬新律师
进行入职培训。
2019年3月至4月,陕西省药品监督管理局分三期对217家药品生产企业质量授权人员进行了岗位培训。
一是深入讲解代理律师的职责任务,强化新任代理律师的责任意识和职业素养,对其专业能力、履职责任、知识结构提出明确要求。
二是指导被授权人的工作方法。如何履行职责,如何获得法律支持,如何促进质量和生产。
三是安排足够的时间进行讨论和交流。主题演讲由优秀授权人主讲,所有授权人都要讲理解和体会,强化培训效果。
企业法人(负责人)
进行全日制培训
陕西省药监局已培训217家企业法人(负责人)。企业法人(负责人)对质量数量授权人制度的认可和配合是《管理办法》实施的关键。重点了解企业法人(负责人)与被授权人的关系,要求企业法人(负责人)充分信任和放手,全力支持质量被授权人的工作,为企业负责,为法人分忧。通过专题讲座和小组讨论,陕西省药监局相关领导与法人(负责人)进行了座谈,使法人受到了深刻的责任意识教育,进一步强化了企业责任意识。
重奖重罚。
严格执行是树立律师制度权威的保证。新管理办法实施以来,陕西省首次对GMP认证和日常检查中存在严重质量缺陷的企业追溯质量受权人履职情况。2019年4月,两名新任命的质量授权人在全省被点名通报批评。同时,积极支持被授权人严格履行职责,坚定尽职信心,安排业绩优秀的优质被授权人外出学习,鼓励其努力工作。随着《管理办法》的实施,这些措施在企业中产生了积极的影响,企业的责任感进一步增强。
进一步的思考和实践
激励药品生产企业落实主体责任是一项大工程。药品生产企业承担着做好药、救民生的历史责任。大部分生产企业都有这样的历史责任,而假冒伪劣和违法犯罪是极少数。监管部门要牢固树立这样的基本判断,成为监管工作的基本依据。从这个意义上说,监管者和生产者是同路人,激发企业的主体责任是监管者的责任和使命,是监管工作的出发点和落脚点。
用好企业质量授权人制度只是“激励药品生产企业落实主体责任”的第一步在贯彻《管理法》的同时,陕西省药品监督管理局也进行了深入实践,在加强严格管理和激励、严查与培训相结合等方面做了一些初步探索。比如修订了《陕西省药品生产企业质量信用等级划分管理办法》,将一般缺陷定量纳入评级依据,鼓励企业既要保安全又要争上游,既要重视严重缺陷和重大缺陷,又不放过任何一个缺陷;修订陕西省药品生产企业质量安全责任约谈制度,改变“有事才约谈”的制度,将纪检监察“四种形态”引入监督,将约谈分为提醒、警示、诫勉、处罚等。,同时也提醒约谈关于法人变更、质量受权人变动频繁等潜在风险状态,鼓励企业将药品安全风险消灭在萌芽状态;大力推进省级专业GMP检查员队伍建设,举行颁发证书和宣誓就职仪式。在要求检查人员树立职业精神、牢记职业誓言、坚守职业道德、严守职业纪律的同时,特别要求检查标准要“严”,要无情,不能手软,但帮助要“善”,时刻牢记激发企业主体责任;计划建立生产企业法人(负责人)和质量授权人培训基地,成为企业核心人员培训提升的一种常态。
对于监管部门来说,激发企业落实主体责任的措施还需要进一步研究,组合拳也要不断出台,真正把落实主体责任变成企业的自觉行动。
作者简介
应洪峰,经济学博士,陕西省药品监督管理局党组成员、副局长。
来源:应洪峰。“药品质量授权人制度”的思考与实践——激励药品生产企业落实主体责任是监管的“牛鼻子”[J]。中国食品药品监督. 2019.06 (185): 10-15。
标签: 药品 责任 主体 落实 企业 监管 鼻子 工作 生产 实践 受权 质量 文摘 制度 周末 思考 激发
相关文章
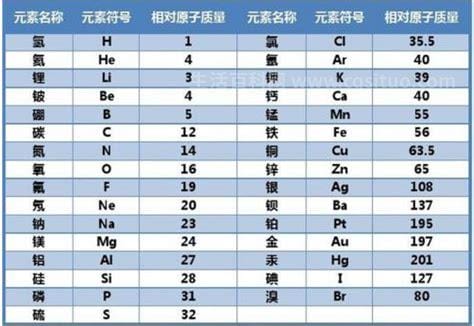
今天我想和大家分享一下关于铁和铜的相对原子质量是多少。以下是小编,对这个问题的总结。让我们来看看。铁和铜的相对原子质量是多少 铁的相对原子质量是56,铜的相对原子质量是64。原子是指化学反应中不可再分的基本粒
2023-12-31 00:24:01
许多朋友不知道中行企业网银数字证书下载,并且对此很疑惑,那么今天就和小编一起来看看吧,一定可以帮助到你。如何使用中国银行企业网银汇款 现在网银的使用越来越方便,企业柜员足不出户就能支付各种款项。本文将详细介绍
2023-12-30 23:12:01

最近很多朋友都遇到了事业节节高升还是步步高升的问题,今天小编就来为大家解答,快来看看吧。事业节节高升还是步步高升 事业步步高升,意味着职位的水涨船高。步步高升出自清代吴《二十年来所见之怪境》第八十八章:且事成
2023-12-30 01:06:01

最近很多朋友都遇到了禁毒法规定禁毒工作机制是什么的问题,今天小编就来为大家解答,快来看看吧。禁毒法规定禁毒工作机制是什么 禁毒工作机制是禁毒工作在政府统一领导下,各有关部门各负其责,社会广泛参与。[法律依据]禁
2023-12-29 20:18:02

许多朋友不知道民主集中制是党的根本什么原则怎么办,对此很疑惑,那么今天就和小编一起来看看吧,一定可以帮助到你。民主集中制是党的根本什么原则 民主集中制是党的根本组织原则。民主集中制:民主基础上的集中和集中指导
2023-12-29 19:48:01