生活的过程中,小伙伴们是不是经常遇到一些很困惑的问题,比如我们今天要说的excel减法函数公式是什么这个问题,要解决这样的问题其实很简单,下面可以跟着小编来具体了解一下吧。在excel中,减法的作用是:IMSUB函数。公式是:A
2024-03-14 22:42:02
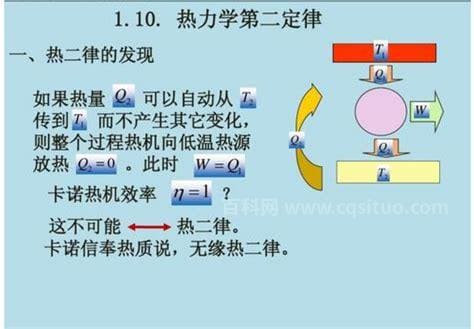
热力学第一定律是能量守恒定律,热力学的另一种解释。他主要是在表明能量不可能凭空产生。热力学第二定律主要解释能量的方向。热力学第二定律有三种表述方式,我们将逐一简要说明。
克劳修斯指出,热量不能自发地从低温物体传递到高温物体。这个表达式指出,热量只能在自然条件下或静止状态下从高温物体传递到低温物体(注意,定律必须在这个前提下成立),不能自动从低温物体传递到高温物体,也就是说,在自然条件下,这个转化过程是不可逆的。要使传热方向可逆,只有通过做功来实现。
开尔文指出,从单一热源获取热量并在没有其他影响的情况下将其完全转化为有用功是不可能的。自然界中任何一种形式的能量都很容易变成热,但反过来,热在没有其他影响的情况下,也不可能完全变成其他形式的能量,这说明这种转化在自然条件下是不可逆的。注意,很重要的一点是没有其他影响,因为没有这句话,就有可能从单一热源获取热量,并完全转化为有用功。说白了,效率100%的机器不可能存在,也就是第二种永动机不存在。
熵增原理:不可逆热力学过程中熵的增量永远大于零。在自然过程中,孤立系统的总混沌度(即“熵”)不会降低。可以理解为混乱是容易的,自发的。改变规则是相对困难的,不可能是自发的。
最后补充两点。
第一,从分子运动理论来看,功是大量分子的规则运动,热运动是大量分子的不规则运动。显然,不规则运动变成规则运动的概率极小,而规则运动变成不规则运动的概率很大。一个孤立的系统不受外界影响,其内部自发过程总是从低概率状态到高概率状态,所以热不可能自发成功。
第二,热力学第二定律只能适用于由大量分子组成的系统和有限范围内的宏观过程。不适用于少数微观系统,也不能推广到无限宇宙。也可以说热力学第二定律无法被严格证明,否则宇宙的焦点就是传说中的“热寂论”。有兴趣的可以自己找找。
总之,热力学第二定律的方向是不可逆的,效率不可能是100%,只能增加熵,做不出第二种永动机。
如果你有今日头条* * *,请关注@中学物理知识传播者。每天都会奉献一篇小干货,我会继续努力!
相关文章
生活的过程中,小伙伴们是不是经常遇到一些很困惑的问题,比如我们今天要说的excel减法函数公式是什么这个问题,要解决这样的问题其实很简单,下面可以跟着小编来具体了解一下吧。在excel中,减法的作用是:IMSUB函数。公式是:A
2024-03-14 22:42:02
最近很多朋友都遇到了word里面怎么求和公式的问题,今天小编就来为大家解答,快来看看吧。【div】【/div】word文档中的求和运算方法如下:1.首先,用word打开文档,找到要求和的表格。2.将光标放在sum值所在的单元格中,然后单
2024-03-14 11:06:01
有许多朋友最近问小编word里插入公式显示不全的问题,那么小编收集整合后,今天为大家分享关于的解答,一起来了解一下吧!首先,选择无法在word2010中完整显示的公式,如图所示。然后选择开始选项卡并单击段落右下角的45度箭头,如
2024-03-11 22:18:02
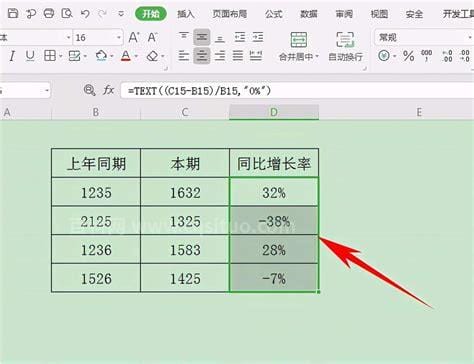
大家在生活的过程中总会遇到一些问题,比如同比的计算公式,那么今天小编就为大家分享关于的相关文章,希望在这篇文章中你能了解到相关内容。计算公式:同比增长率=(期数-期数)÷期数×100%。某个指标的同比增长率=(当前某个
2024-03-10 04:24:01
excel函数if公式怎么用?希望不清楚的大家在这看一看,小编已经为大家把这个问题总结好了,希望接下来的能帮大家解决这个问题,看完了记得分享哦!边肖通过一个简单的例子告诉你如何使用if公式!假设数据在A1输入,在B1判断。如果
2024-03-10 03:42:02