生活的过程中,小伙伴们是不是经常遇到一些很困惑的问题,比如我们今天要说的excel减法函数公式是什么这个问题,要解决这样的问题其实很简单,下面可以跟着小编来具体了解一下吧。在excel中,减法的作用是:IMSUB函数。公式是:A
2024-03-14 22:42:02
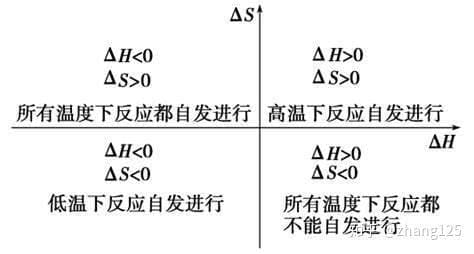
吉布斯自由能公式是G=H-TS。
吉布斯自由能是化学热力学中引入的判断过程方向的热力学函数。也称为自由焓、吉布斯自由能或自由能。
自由能是指在一定的热力学过程中,系统减少的内能中可以转化为对外做功的部分。在物理化学中,自由能的定义是亥姆霍兹的定容自由能f和吉布斯的定压自由能g,吉布斯自由能是自由能的一种。
等温公式
吉布斯自由能随温度和压力变化很大。为了找到非标准条件下的吉布斯自由能,可以使用范特霍夫等温公式:
δG =δG0+RT ln Q .
其中δ G0是相同温度和标准压力下的吉布斯自由能,r是气体常数,q是反应熵。
温度的变化表现在δ G0的使用上,不同的温度使用不同的δ G0。非标准条件的δG0需要用定义公式(吉布斯等温公式)计算。压力或浓度的变化显示在q的表达式中。
发展
任何体系中的相变或化学反应必然是自发的不可逆过程。根据热力学第二定律,这个过程的结果必然是增加系统的熵。吉布斯自由能判据是恒温恒压下熵判据的一种常见特殊形式。对于一个不处于平衡状态的任意封闭系统,它与环境之间存在能量交换。这种非绝热特性使得外界能量输入对反应体系中熵值的影响不可忽略。因此,在判断反应是否自发时,我们需要计算反应体系和环境整体的熵值,然后利用总熵的变化来判断反应的方向。
1876年,美国著名数学物理学家和数学化学家吉布斯在《康涅狄格科学院学报》上发表了奠定化学热力学基础的经典著作《论异质物体的平衡》的第一部分。他在1878年完成了第二部分。这篇长达300页的论文被视为化学史上最重要的论文之一,其中提出了吉布斯自由能和化学势的概念,阐述了化学平衡、相平衡和表面吸附的本质。
相关文章
生活的过程中,小伙伴们是不是经常遇到一些很困惑的问题,比如我们今天要说的excel减法函数公式是什么这个问题,要解决这样的问题其实很简单,下面可以跟着小编来具体了解一下吧。在excel中,减法的作用是:IMSUB函数。公式是:A
2024-03-14 22:42:02
最近很多朋友都遇到了word里面怎么求和公式的问题,今天小编就来为大家解答,快来看看吧。【div】【/div】word文档中的求和运算方法如下:1.首先,用word打开文档,找到要求和的表格。2.将光标放在sum值所在的单元格中,然后单
2024-03-14 11:06:01
有许多朋友最近问小编word里插入公式显示不全的问题,那么小编收集整合后,今天为大家分享关于的解答,一起来了解一下吧!首先,选择无法在word2010中完整显示的公式,如图所示。然后选择开始选项卡并单击段落右下角的45度箭头,如
2024-03-11 22:18:02
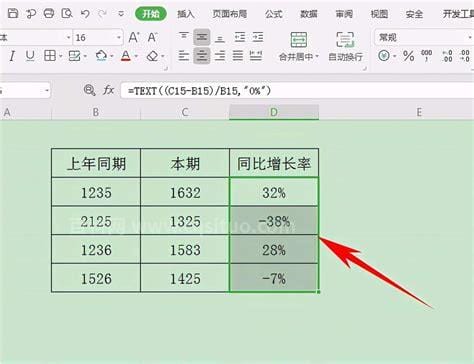
大家在生活的过程中总会遇到一些问题,比如同比的计算公式,那么今天小编就为大家分享关于的相关文章,希望在这篇文章中你能了解到相关内容。计算公式:同比增长率=(期数-期数)÷期数×100%。某个指标的同比增长率=(当前某个
2024-03-10 04:24:01
excel函数if公式怎么用?希望不清楚的大家在这看一看,小编已经为大家把这个问题总结好了,希望接下来的能帮大家解决这个问题,看完了记得分享哦!边肖通过一个简单的例子告诉你如何使用if公式!假设数据在A1输入,在B1判断。如果
2024-03-10 03:42:02