有些小伙伴经常会碰到准确率100的生男生女公式的问题,但是对于不是非常了解,给小伙伴带来了很多困惑,但小伙伴们找到这里算是没白来,因为小编就带大家详细讲解一下,具体内容如下。很多孕妇特别想知道胎儿的性别,以便给孩子
2023-11-20 10:48:01
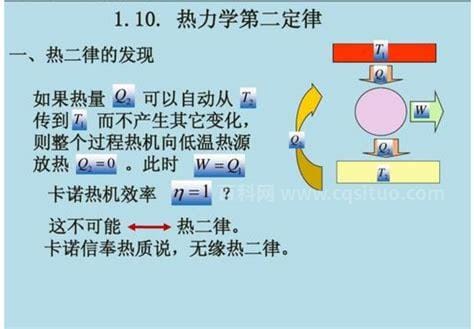
热力学第一定律是能量守恒定律,热力学的另一种解释。他主要是在表明能量不可能凭空产生。热力学第二定律主要解释能量的方向。热力学第二定律有三种表述方式,我们将逐一简要说明。
克劳修斯指出,热量不能自发地从低温物体传递到高温物体。这个表达式指出,热量只能在自然条件下或静止状态下从高温物体传递到低温物体(注意,定律必须在这个前提下成立),不能自动从低温物体传递到高温物体,也就是说,在自然条件下,这个转化过程是不可逆的。要使传热方向可逆,只有通过做功来实现。
开尔文指出,从单一热源获取热量并在没有其他影响的情况下将其完全转化为有用功是不可能的。自然界中任何一种形式的能量都很容易变成热,但反过来,热在没有其他影响的情况下,也不可能完全变成其他形式的能量,这说明这种转化在自然条件下是不可逆的。注意,很重要的一点是没有其他影响,因为没有这句话,就有可能从单一热源获取热量,并完全转化为有用功。说白了,效率100%的机器不可能存在,也就是第二种永动机不存在。
熵增原理:不可逆热力学过程中熵的增量永远大于零。在自然过程中,孤立系统的总混沌度(即“熵”)不会降低。可以理解为混乱是容易的,自发的。改变规则是相对困难的,不可能是自发的。
最后补充两点。
第一,从分子运动理论来看,功是大量分子的规则运动,热运动是大量分子的不规则运动。显然,不规则运动变成规则运动的概率极小,而规则运动变成不规则运动的概率很大。一个孤立的系统不受外界影响,其内部自发过程总是从低概率状态到高概率状态,所以热不可能自发成功。
第二,热力学第二定律只能适用于由大量分子组成的系统和有限范围内的宏观过程。不适用于少数微观系统,也不能推广到无限宇宙。也可以说热力学第二定律不能被严格证明,否则宇宙的焦点就是传说中的“热寂论”。有兴趣的可以自己找找。
总之,热力学第二定律的方向是不可逆的,效率不可能是100%,只能增加熵,做不出第二种永动机。
如果你有今日头条* * *,请关注@中学物理知识传播者。每天都会奉献一篇小干货,我会继续努力!
相关文章

有些小伙伴经常会碰到准确率100的生男生女公式的问题,但是对于不是非常了解,给小伙伴带来了很多困惑,但小伙伴们找到这里算是没白来,因为小编就带大家详细讲解一下,具体内容如下。很多孕妇特别想知道胎儿的性别,以便给孩子
2023-11-20 10:48:01

生活中有许多朋友问小编准确率100的生男生女公式,那么今天小编就为大家解决一下这个问题,希望对你有所帮助。很多准妈妈都很好奇自己肚子里胎儿的性别,但是医生又说不出胎儿的性别,所以只能在网上寻找鉴定胎儿性别的方法
2023-11-19 21:48:01

大家好,kj和卡路里换算公式小编来为大家解答。呢,很多朋友还不理解,现在让我们一起来介绍下,希望能帮助到你!卡路里是一个能量单位,它被定义为在1个大气压下将1克水升高1摄氏度所需的热量。卡路里在营养测量和健身手册中被
2023-11-19 02:09:01

有许多的朋友最近问小编男人能熬多久不碰女人的问题,那么小编收集整合后,今天为大家分享关于的相关文章,一起来了解一下吧!通常男人可以七天不碰女人。一旦超过7天不碰女人,就会有一种冲动,出现频繁射精,性欲增强,遗精,忍不住
2023-11-10 18:48:01
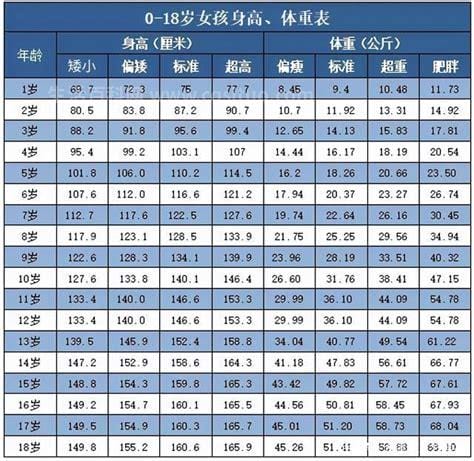
大家在生活的过程中总会遇到一些问题,比如1一18岁身高体重标准表范围计算公式2023优质,那么今天小编就为大家分享关于的相关文章,希望在这篇文章中你能了解到相关知识。孩子的健康成长是家长们头疼的问题。许多家庭每年
2023-11-10 16:27:01